EBV R-gene®
Real-Time PCR-Kit für den präzisen qualitativen und quantitativen Nachweis von Epstein-Barr-Virus (EBV)-DNA
- Präzise Quantifizierung der EBV-Viruslast über einen breiten linearen Messbereich*
- Gebrauchsfertiger Kit inklusive interner Kontrolle & Quantifizierungsstandards
- CE-zertifiziertes IVD für alle relevanten Extraktionsplattformen & Real-Time PCR-Systeme und zahlreiche Probenarten
Benötigen Sie weitere Informationen?
Vorteile von EBV R-gene®
Das Epstein-Barr-Virus (EBV) gilt als ätiologischer Erreger der infektiösen Mononukleose und ist verantwortlich für die Proliferation der B-Lymphozyten (Posttransplantations-Lymphoproliferative Erkrankung (PTLD), Burkitt-Lymphom, Hodgkin-Lymphom, …), einer für Patienten mit geschwächtem Immunsystem schwerwiegenden Komplikation. Bei einer EBV-Infektion ist ein eindeutiger Nachweis und die Infektionsüberwachung wesentlich für die bestmögliche Patientenversorgung. EBV R-gene® ist die ideale Lösung für einen schnellen und spezifischen Nachweis auch schon vor dem Auftreten klinischer Symptome. Ein frühzeitiger Nachweis erlaubt ein besseres Infektionsmanagement, eine bessere Beurteilung der Wirksamkeit von Behandlungsmaßnahmen und eine bessere Überwachung von Rezidiven. Für umfassendere Tests zur Quantifizierung unterschiedlicher Viren in einer Probe oder zur Analyse mehrerer Proben gleichzeitig auf einen Erreger steht Ihnen eine breite R-gene®-Produktlinie zur Verfügung.
- Empfindlich und reproduzierbar
- Zuverlässiger Nachweis einer EBV-Infektion
- Breiter linearer Messbereich
- Standardisiert
- Einheitliches Verfahren für die gesamte R-gene®-Produktlinie (CMV R-gene®, HSV1 HSV2 VZV R-gene®, CMV HHV6, 7, 8 R-gene®, BK Virus R-gene®, Adenovirus R-gene®, Parvovirus B19 R-gene®).
- Einheitliche Testprotokolle für verschiedene Tests in einem Lauf.
- Protokoll zur Umrechnung der Quantifizierungsergebnisse in IU/ml mit Hilfe des 1. Internationalen WHO-Standards.
- Flexibel
- Für zahlreiche klinisch relevante Probenarten validiert
- Vorbereitung und Verarbeitung der Proben manuell oder mit automatisierten Plattformen wie dem NucliSENS® easyMAG® oder dem easySTREAM™ Pipettiersystem
- Für alle relevanten Real-Time PCR-Plattformen qualifiziert
Alle Reagenzien in einem Kit
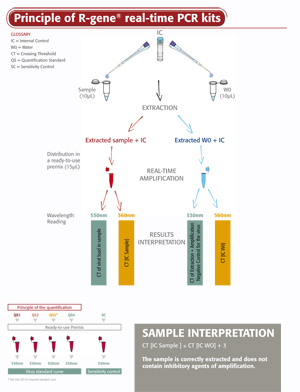
Das EBV R-gene® Kit ist ein gebrauchsfertiger Kit zur Bestimmung der EBV-Viruslast in DNA-Extrakten von verschiedenen klinisch relevanten Probenarten. Das Testprinzip basiert auf der Amplifikation und dem quantitativen Nachweis einer spezifischen Region des EBV-Genoms mittels der 5’-Nuclease-basierten Real-Time PCR.
- Vier Quantifizierungsstandards gewährleisten die präzise Bestimmung der EBV-Viruslast
- Eine Sensitivitätskontrolle validiert die Leistung des Tests
- Eine Interne Kontrolle (IC2) überprüft die Extraktion, einschließlich der Lyse und das Vorliegen von DNA-Inhibitoren in der Probe
- Alle erforderlichen IVD-Reagenzien für den optimierten Nachweis und zur Quantifizierung des EBV sind gebrauchsfertig:
- Geringere Personalbindung
- Geringere Risiko von Handhabungs- oder Verdünnungsfehlern
- Geringere Kontaminationsrisiko
Einfaches Verfahren
Der EBV R-gene®-Kit ist benutzerfreundlich. Einfach die extrahierte DNA zu dem gebrauchsfertigen PCR-Master-Mix geben, die Reaktion auf dem entsprechenden Real-Time PCR-Thermocycler starten und anschließend das in der Gebrauchsanweisung beschriebene, optimierte Cycling-Programm durchführen.
BIOMERIEUX, das blaue Logo, ARGENE®, R-gene®, EASYMAG® und NUCLISENS® sind verwendete, angemeldete und/oder eingetragene Marken von bioMérieux, einer ihrer Niederlassungen oder eines ihrer Unternehmen. Alle anderen Marken und Produktnamen sind Eigentum ihrer jeweiligen Besitzer.
Any other name or trademark is the property of its respective owner. - See more at: http://clinical.biomerieux.net/cmv-r-gene-0#sthash.YR9WVorN.dpuf
Any other name or trademark is the property of its respective owner. - See more at: http://clinical.biomerieux.net/cmv-r-gene-0#sthash.YR9WVorN.dpuf
Any other name or trademark is the property of its respective owner. - See more at: http://clinical.biomerieux.net/cmv-r-gene-0#sthash.YR9WVorN.dpuf
| EBV R-gene® (69-002B) | |
|---|---|
| Testprinzip | Genom-Nachweis und Quantifizierung des EBV |
| Bestellinformation | EBV R-gene®, Best.-Nr. 69-002B Kit für die Quantifizierung auch unter der Best.-Nr. 69-002: EBV R-gene® Komplett-Kit für die Quantifizierung (enthält Best.-Nr. 69-002B Kit für die Quantifizierung und Best.-Nr. 67-000 DNA-Extraktions-Kit) |
| Technologie | Real-Time PCR/5‘-Nuklease-Taqman-Technologie |
| Target-Gen | BXLF1-Gen, kodiert die Thymidinkinase |
| Proben* | Vollblut, Plasma, Liquor, Biopsieproben, BAL |
| Nachweisgrenze | 4 Kopien/PCR |
| Dynamischer Quanti-fizierungsbereich | Bis zu 5x106 Kopien/ml |
| Im Kit enthaltene Kontrollen | Kontrolle für Extraktion + Hemmung, Sensitivitätskontrolle, Negativkontrolle |
| Zeit bis zum Vorliegen des Ergebnisses | 75 Minuten (nach Extraktion) |
| Berichtseinheit | Kopien/ml oder umrechnen in IU/ml mit Hilfe des 1. Internationalen WHO-Standards |
| Anzahl Tests | 90 Tests |
| Lagerungsbedingungen |
-18 °C/-22 °C (Best.-Nr. 69-002B, Quantifizierungs-Kit) +2 °C/+8 °C (Best.-Nr. 67-000, Kit zur DNA-Extraktion) |
| Validierte manuelle und automatisierte Extraktionsplattformen* | QIAamp DNA Blood Mini Kit, NucliSENS® easyMAG®, MagNA Pure Compact, MagNA Pure LC, QIAcube, QIAsymphony SP, m2000sp, VERSANT kPCR Molecular System SP |
| Validierte Amplifikationsplattformen* | Life Technologies (Applied Biosystems), LightCycler, SmartCycler, RotorGene, VERSANT kPCR Molecular System AD, Biorad DX Real-Time System, Stratagene (Agilent) |
| Status | Für die In-vitro-Diagnostik |
* auf Anfrage
„Fast facts“ zum EBV
Was ist EBV?
Das Epstein-Barr-Virus (EBV) ist ein ubiquitäres Herpesvirus, mit dem die Mehrheit der menschlichen Bevölkerung infiziert ist. Nach der Primärinfektion (Übertragung mittels Speichel) verbleibt das EBV latent in den B-Zellen und kann bei gesunden Personen regelmäßig reaktiviert werden. Diese Reaktivierung tritt mit einer Replikation des EBV in den Epithelzellen des Mundrachenraums auf und verursacht keinerlei klinische Krankheitsanzeichen.
Welche Personen sind besonders gefährdet?
Das EBV ist der ursächliche Erreger einer Reihe von klinischen Zuständen wie der infektiösen Mononukleose (IM) und ist an der Entstehung verschiedener Krebsformen beteiligt wie dem Burkitt-Lymphom, Hodgkin-Lymphom und Nasopharynx-Karzinom. Bei immunsupprimierten Patienten kann eine unkontrollierte EBV-induzierte Proliferation der B-Zellen nach erfolgter Transplantation zu einer lymphoproliferativen Erkrankung (Post-transplant Lymphoproliferative Disorder, PTLD) führen, die eine Hauptursache für die Morbidität und die Sterberate sowohl bei Patienten mit Organtransplantation als auch bei HSCT-Patienten darstellt.
Welche Vorteile bietet der molekularbiologische Nachweis des EBV?
Real-Time PCR-basierte Methoden für die Diagnostik des EBV ermöglichen schon vor dem Auftreten klinischer Krankheitszeichen einen schnellen und spezifischen Nachweis und tragen so zu einem besseren Behandlungserfolg bei. Dies betrifft vor allem immunsupprimierte Patienten, die besonders gefährdet sind, an einer Infektion und den schwerwiegenden Folgen zu erkranken. Die Real-Time PCR für den quantitativen Nachweis des EBV kann zur frühzeitigen Diagnostik, zur Verfolgung des Krankheitsverlaufs und zur Überwachung des Behandlungserfolges bei einer PTLD eingesetzt werden.
EBV R-gene® und 1. Internationaler WHO- Standard für das Epstein-Barr-Virus (EBV)
Benötigen Sie einen Umrechnungsfaktor zur Berechnung Ihrer Ergebnisse aus den Tests mit dem EBV R-gene®-Kit in IU/ml?
Bitte laden Sie sich das Protokoll zur Berechnung herunter.
R-gene®: VERÖFFENTLICHUNGEN
- Evaluation of the Epstein-Barr virus R-gene quantification kit in whole blood with different extraction methods and PCR platforms
Fafi-Kremer et al.
J Mol Diagn. 2008 Jan;10(1):78-84. Epub 2007 Dec 28
- Measurement of HSV1, CMV, HHV6 and EBV viral loads in 83 bronchoalveolar lavage (BAL) from lung transplant recipients.
Germi et al.
Unit of Virus Host Cell Interactions, Grenoble
ESCV 2011
- Evaluation de la trousse EBV R-gene (Argene) : Mesure de la charge virale EBV dans des prélèvements de sang total et dans les échantillons du panel européen QCMD
Brunet et al.
Service de virologie, Groupe Hospitalier Pitié-Salpêtrière, AP-HP, Paris
RICAI 2010
- Intérêt de la PCR quantitative EBV dans le suivi des greffés de moelle osseuse en pédiatrie
Billaud et al.
Laboratoire de Virologie, Hopital Debrousse, Lyon.
RICAI
- Comparative evaluation of the NucliSENS® easyMAG™ automated system for the extraction of viral DNA from whole blood samples: application to the monitoring of cytomegalovirus (CMV) and Epstein-Barr virus (EBV) loads
Pillet et al
Laboratoire de Bacteriologie-Virologie-Hygiène, Hopital Nord, CHU de Saint-Etienne, France.
ECCMID 2008
- Clinical and Laboratory Evaluation of the new Argene EBV DNA quantitative real-time PCR assay (R-gene)
Laura Jane Scott et al
West Scotland Specialist Virology Centre, Gartnavel General Hospital, Glasgow, Scotland.
International Symposium on molecular diagnostics, 2006